グルタミン酸, Glutamate, Gln, E
- 概要: グルタミン酸とは
- 神経伝達物質としてのグルタミン酸
- グルタミン酸 - グルタミンサイクル
- 脳内の分布
- グルタミン酸受容体
- 生合成
- α-KG からの生合成 その 1
- α-KG からの生合成 その 2
- 生合成の制御
- 分解
概要: グルタミン酸とは
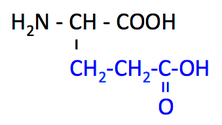
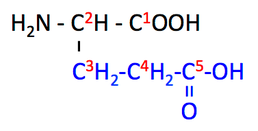
グルタミン酸 glutamic acid とは,左のような構造をもつアミノ酸で,Glu または E と略記される。
黒字はアミノ酸の基本骨格,青字が側鎖,下の構造式にある赤の数字は炭素番号である。 -COOH という 酸性の側鎖 をもつ(10)。
pH 7 前後の水溶液中では,2 つの COOH 基が COO- に,NH2 が NH3+ になっている。つまり,負に荷電している。この点を強調するために,glutamate と呼ばれることが多い。
なお,C5 の OH 基が NH2 になっているのがグルタミン Gln である。
タンパク質構成アミノ酸として
> 負電荷をもっており,タンパク質の表面に位置して水溶性を付与する(9)。
> タンパク質をポリグルタミン酸テールとして修飾することがある(9)。
: たとえば tubulin は poly-Glu 修飾を受け,これによって他のタンパク質との結合性に影響が出る。
> ビタミン K 依存的なカルボキシル化を受けて,カルシウム結合性が増大する(9)。
遊離アミノ酸として(文献9)
> 摂取した Glu は消化の過程で 70-90% 以上が分解されてしまう。体内の遊離 Glu は生合成されたもの。
> システイン Cys,グリシン Gly とともに,トリペプチドであるグルタチオン glutathione の材料となる。
> 興奮性の神経伝達物質であるほか,抑制性の神経伝達物質 GABA を合成する材料になる。
> 膵臓 β-細胞からのインスリン insulin 分泌を制御するシグナル分子としてはたらく。
> IMP との相乗効果で旨味を呈する。
食品成分として
> グルテン(小麦中のタンパク質の総称)の加水分解物から発見された(10)。
> L 体のモノナトリウム塩 sodium glutamate は旨味を呈し,味の素の主成分。D 体は美味でない(1)。
神経伝達物質としての Glu
グルタミン酸 - グルタミンサイクル
Gluは,興奮性神経伝達物質 excitatory neurotransmittor として重要な役割を果たすアミノ酸である(1, 10他)。以下のように働き,この一連の流れを グルタミン酸-グルタミンサイクルという。詳細はこちらへ。
また,シナプス のページではシナプスを介した伝達の各ステップを詳細にまとめてある。
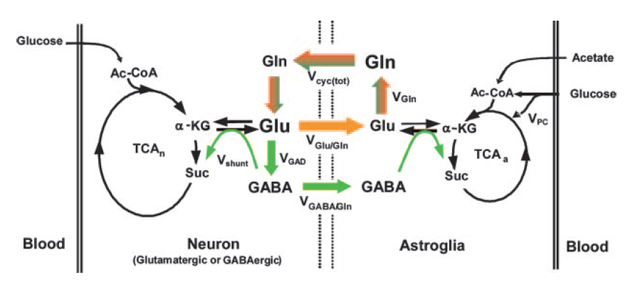
上の図は文献 13 から,右の図はWikipedia「シナプス」よりそれぞれ転載。
右図で 2 がグルタミン酸を含む小胞,5 が受容体である。
- Neuron のシナプス前膜 presynaptic membrane からシナプス間隙 synaptic cleft に放出されたGlu は,シナプス後膜 postsynaptic membrane の受容体に結合し,活動電位を発生させる。
- そのままだとニューロンが興奮しっ放しになってしまうので,Glu は速やかにアストロサイト astrocyte に取り込まれる。アストロサイト内では,Glu はグルタミン合成酵素によってグルタミン Gln に変換される。
- グルタミンはアストロサイトから放出される。ニューロンはこれを取り込んで Glu に変換し再利用する。
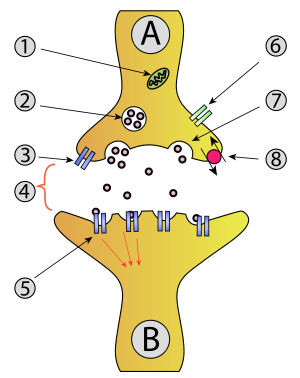
グルタミン酸受容体 Glutamate receptor
グルタミン酸の受容体は,イオンチャネル性受容体 [M-methyl-D-aspartate (NMDA) receptor, α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor (AMPA) receptor] と,代謝性グルタミン酸受容体に大別できる。
NMDA 受容体は,通常の速い神経伝達とは異なり,海馬におけるシナプスの長期増強やシナプス形成と関連するため,記憶との関連が注目されている。
その他未整理
> 脳では,Glu-Gln cycle と anaplerosis のみが Gl u合成のための炭素骨格を供給する反応である(4)。
> Astrocyteはシナプス間隙からのGlu clearanceの主役。様々な病気でGlu輸送に異常がみられる(2I)。
> 主要なGlu transporter: GLAST, GLT-1, EAAC-1. 前 2 者は astrocyte, EAAC-1 は neuronにある(2R)。
> ニューロンで Glu を Gln に加水分解するのは,phosphate-activated glutaminase (PAG) である(7)。
> 幼少期マウスへのhyperoxiaでastrocyte Glu uptake阻害,脳の発生異常が起こる(2R)。
> この阻害は,non-GLT-1-mediated Glu uptake である(2R)。
脳内の分布
> rat, ヒトの脳では,グルコース酸化で得られるエネルギーの80%が神経活動とGlu-Glnに使われる(7)。
> ヒトの脳には,10 - 12 mMという高濃度で存在する(9)。
> これは脳全体での値で,例えばcerebrospinal fluid では1 μM,分泌顆粒では100 mMなど勾配あり(9)。
> アストロサイトの Glu pool は,0.5 - 1 mM(7)。
> ラット脳では,部位によっても濃度に違いがあることが明らかにされている。
: Prefrontal cortex 12.3 ± 0.6 μmol/g,hippocampus 11.3 ± 0.4 μmol/gで有意に異なる(11)。
> 虚血 ischemia,肝性脳症 hepatic encephalopathy,Rett'sシンドロームなどで大脳皮質濃度が上がる(5)。
生合成
Glu はタンパク質を構成するだけでなく,遊離アミノ酸としても重要な生理機能をもつが,ヒトやラットでは餌に含まれる Glu は腸でほぼ全て分解されてしまう(9)。したがって,体内で機能する Glu はほぼ全て生合成に由来する。
生合成には大きく分けて 2 つの経路がある。生合成に影響を及ぼす要因とともに以下に示す。
1. α-ケトグルタル酸からの生合成
グルタミン酸は,TCA回路 の α-ケトグルタル酸 α-ketoglutarate (α-KG)を基質として合成される。さらに以下の2 つの反応にわけることができる。これは,以下の図にみるように両者が構造的に似ていて,アミノ基の付加を付加するだけで良いためである。
1-1. アンモニウムイオン NH4+ を使う
グルタミン酸デヒドロゲナーゼに触媒される反応である(6)。デヒドロゲナーゼは脱水素酵素なので,この反応は逆反応である。
NH4+ + α-KG → Glu + H2O
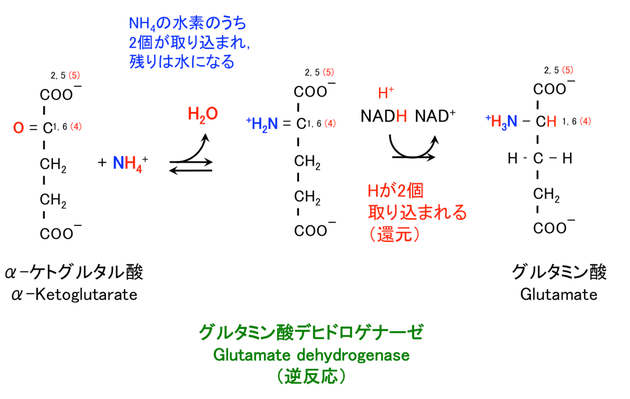
> NADHのほか,NADPHが使われることもある。
: NADH, NADPH の両方を使うことができる珍しい生化学反応である。
> 炭素番号は グルコースのラベル実験 に関連する。
: 1, 2, 5, 6 は α-KG がグルコース由来である場合の,もとのグルコースの炭素番号。
: グルコースは解糖および TCA 回路を経て α-KG になる。
: このことから,グルコースの C1 および C6 は Glu C4 に,C2 および C5 は Glu C5 に入ることがわかる。
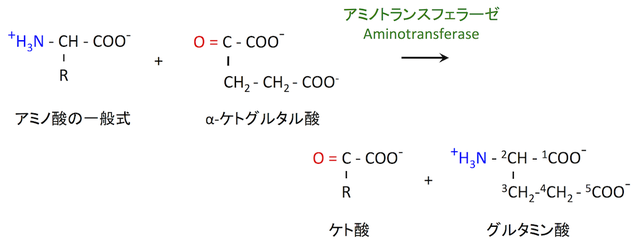
1-2. 他のアミノ酸からアミノ基をもってくる
アミノトランスフェラーゼ aminotransferase に触媒される反応である(6)。グルタミン酸の生合成というよりも,アミノ酸分解反応の一環として考えたほうがよい。
2. 生合成の制御
リルゾール Riluzole
> リルゾールは筋萎縮性側索硬化症 ALS の治療薬。シナプスへのGlu放出を抑制すると考えられている(11I)。
> しかし Glc からの Glu 生合成をラットで促進するという結果もあり,作用機序はまだ不明な点が多い(11R)。
分解
Glu dehydrogenase による分解
グルタミン酸デヒドロゲナーゼ glutamate dehydrogenase の作用でアミノ基が取り去られ,α-KG になる(6)。上記の生合成の逆反応である。
- 主に肝臓で起こる。この反応は常に平衡に近い状態にあり,単純に基質の量で合成・分解のどちらに流れるかが決まる(6)。
- グルタミン酸デヒドロゲナーゼはミトコンドリアに局在する。有毒な NH4+ を隔離するためと考えられており,実際に尿素合成系もミトコンドリアにある(6)。
α-KG は TCA 回路に取り込まれる。
References
- 岩波 理化学辞典 第5版.
- Schmitz et al. 2011a. Cellular changes underlying hypoxia-induced delay of white matter development. J Neurosci, 31, 4327-4344.
- Fitzpatrick et al. 1990a. The flux glucose to glutamate in the rat brain in vivo as determined by 1H-observed, 13C-edited NMR spectrometry. J Cereb Blood Flow Metab, 10, 170-179.
- de Graaf et al. 2011a (Review). State of the art direct 13C and indirect 1H-[13C] NMR spectrometry in vivo. A practical guide. NMR Biomed 24, 958-972.
- Govindaraju et al. 2000a. Proton NMR chemical shifts and coupling constants for brain metabolites. NMR Biomed 13, 129-153.
- Berg et al. Biochemistry
- de Graaf et al. 2003a (Review). In vivo 1H-[13C]-NMR spectrometry of cerebral metabolism. NMR Biomed 16, 339-357.
- de Graaf et al. 2004b. Regional glucose metabolism and glutamatergic neurotransmission in rat brain in vivo. Proc Natl Acad Sci USA 101, 12700-12705.
- Brosnan and Brosnan 2013a (Review). Glutamine: a truly functional amino acid. Amino Acids 45, 413-418.
- 河合良訓 監修. 脳単―ギリシャ語・ラテン語 (語源から覚える解剖学英単語集 (脳・神経編)). 株式会社エヌ・ティー・エス.
- Chouwdhury et al. 2008a. Chronic riluzole treatment increases glucose metabolism in rat prefrontal cortex and hippocampus. J Cereb Blood Flow Metab 28, 1892-1897.
- Patel et al. 2001a. Glutamine is the major precursor for GABA synthesis in rat cortex in vivo following acute GABA-transaminase inhibition. Brain Res 919, 207-220.
- Patel et al. 2005a. The contribution of GABA to glutamate/glutamine cycling and energy metabolism in the rat cortex in vivo. PNAS 102, 5588-5593.