リポタンパク質リパーゼ LPL の酵素活性
2022/12/20 Last update
このページは リポタンパク質リパーゼ @本家UBサイト に恒久的に移転しました。このページもネット上に残っていますが、最新の情報はリンク先を参照して下さい。
- 基質特異性
- 酵素活性の測定法
構造と活性
GXSXGのSerが活性中心(3)
基質特異性
LPL はリポタンパク質 lipoprotein 中のトリアシルグリセロールを基質とするが,加水分解しやすい位置が決まっており,またジアシルグリセロール DAG も加水分解できることなども知られている。
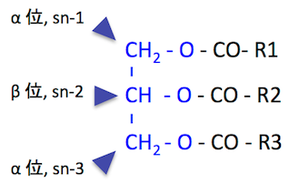
参考: トリアシルグリセロール TAG の分子構造
> トリアシルグリセロール TAG の sn-1 位を優先的に加水分解する(4R)。
: 2,3-sn-ジアシルグリセロール(DAG)が分解産物の中で 70-91% を占めることから。
: 1,3-sn-DAG も30%程度は存在する。
> 1,2-sn-DAG の sn-1 位も加水分解することができる(2R)。
酵素活性の測定法
14C で標識したトリオレイン(オレイン酸が3個ついているトリアシルグリセロール TG)を基質として,LPL の酵素作用によって遊離した 14C-オレイン酸の存在量を測定する方法が古い文献ではよく使われている。
この反応を触媒する酵素は他にもあるが,1 M NaCl で活性が阻害されるのが LPL の特徴であるため,これを利用して LPL の活性を算出することができる。
NaCl による阻害
> NaCl および下記の protamine sulfate によって阻害されるのが LPL 活性の特徴である(4)。
Protamine sulfate による阻害
> 3 mg/ml protamine sulfate でも活性が阻害される(1)。
References
- Eckel & Robbins 1984a. Lipoprotein lipase is produced, regulated, and functional in rat brain. PNAS 81, 7604-7607.
- Morley et al. 1975a. Hydrolysis of diacylglycerol by lipoprotein lipase. J Biol Chem 250, 3414-3418.
- Wong & Schotz 2002a (Review). The lipase gene family. J Lipid Res 43, 993-999.
- Morley et al. 1972a. Positional specificity of lipoprotein lipase. J Biol Chem 247, 6389-6393.