線条体: Striatum(ヒト)
- 概要: 線条体とは
- 中型有棘細胞 MSN
- 線条体のドーパミンシグナル
- D2R 量と肥満
- D2R 量と統合失調症
線条体とは
線条体 striatum は,大脳基底核 basal ganglia と呼ばれる神経細胞 neuron が集中した領域の主要な構成要素である(8)。
Basal ganglia は大脳皮質のほとんど全ての領野から入力を受けているが,その 最初の受け手 が線条体である。
線条体は,投射パターンや神経伝達物質の分布によって,パッチとマトリックスに分類することができるとされている(10)が,以下に示す dorsal/ventral の分類がもっとも論文で目にとまるようである。
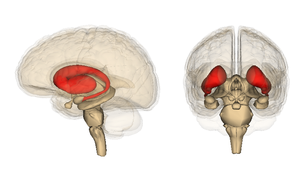
ヒトの線条体 (9)
構造
ヒトの線条体は,右上の図の赤い部分に存在する。さらに詳細な構造は以下のようになっている(1)。
大脳基底核 Basal ganglia
線条体 Striatum (腹側線条体 dorsal striatum)
被殻 Putamen
尾状核 Caudate nucleus
尾状核頭 Head of caudate nucleus
尾状核体 Body of caudate nucleus
尾状核尾 Tail of caudate nucleus
視床下核 Subthalamic nucleus
淡蒼球 Globus pallidus
外節 External segment
内節 Internal segment
背側線条体 Ventral striatum
嗅結節 Olfactory tubercle
線条体は 被殻と尾状核の総称 であり,いわゆる錐体外路系の中枢である(1)。発生学的には淡蒼球 Globus pallidus の方が古いため,これを旧線条体,線条体のことを新線条体と呼ぶこともあると書かれているが,この名称はあまりみたことがない。
被殻と尾状核からなる部分を dorsal striatum とし,NAc および olfactory tubercle を ventral striatum と呼ぶこともある。この呼び方は,現在ではかなり一般的なように思われる。
被殻と淡蒼球を合わせてレンズ核 Lentiform nucleus と呼ぶこともあるが,この名前は最近はあまり使われない。
機能
報酬系 reward system および運動の制御が線条体の重要な機能である。
運動制御
大脳基底核による運動制御のよい総説があったので(13),これに基づいてまとめる。文献 13 では線条体でなく「大脳基底核」という言葉が使われているが,上述のように大脳基底核への投射は線条体が受けているので,線条体は以下の運動制御において重要な役割を果たしていると言えるだろう。
> 基底核は大脳皮質から投射を受け,大脳皮質,辺縁系および脳幹へ出力する(13)。
: 大脳皮質 - 基底核ループには,運動,認知,辺縁系,眼球運動があり,運動だけでなく精神機能も制御。
: 姿勢や歩行などは,基底核 - 脳幹系で制御される。
中型有棘細胞
中型有棘細胞 mediam spiny neuron, MNS は,線条体の 90 - 95% を占めるニューロンである(8)。
> ドーパミン受容体の発現パターンで,さらに 2 種類にわけられる(12)。
: Striatonigral/direct pathway neurons は D1R を発現する。
: D1R 下流シグナルの詳細は,ドーパミン受容体のページに示す。
: Striatopallidal indirect pathway neurons は D2R を発現する。
> 麻酔下および深い眠りにあるラットで,静止膜電位 の 双安定性 を示す(8)。
: その意義は不明だが,覚醒状態ではみられないため,睡眠中の情報処理に関係しているかもしれない。
: 線条体と運動との関わりから,動いている状態での膜電位を調べたいが,現在の技術では不可能。
> 大脳皮質からの入力を遮断すると,ダウン状態からアップ状態への遷移がみられなくなる(8)。
: 大脳皮質によって制御されていることを示唆する。
線条体のドーパミンシグナル
線条体は,ドーパミン神経が投射している領域の一つである。
黒質 substantial nigra からの投射があり,運動および報酬系との関係が重要である。この神経が変性するとパーキンソン病 Parkinson disease になる。
線条体では,D1 および D2 という 2 つのドーパミン受容体が発現している(12)。
線条体の 90 - 95% を占めるニューロンである MSN のうち,Striatonigral/direct pathway neurons が D1R を発現している。
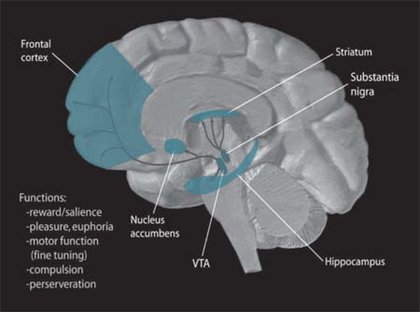
D2R 量と肥満
線条体の D2R 量は,肥満 obesity では低下,統合失調症 schizophrenia では増大する傾向にあるようである。しかし,いずれの場合もD2R 量の変化が病気の原因であるか結果であるかはわからない。
肥満の場合,線条体の D2R 量が低いと,衝動的な食欲を止められなくなる という仮説が提唱されている。この「食欲の理性による抑制」は高度な脳 brain の活動であり,大脳皮質 cortex で制御される。大脳皮質のどの領域が関係しているかについては,以下のように諸説がある。
> ヒトでは,D2R の発現量低下に繋がるような多型と,肥満のリスクが associate している(2D)。
> 線条体のD2R量が低いヒトほど,ストレスで物を食べる方向に応答することがわかっている(2I)。
: 別の研究でも,BMI > 40 の肥満のヒトは線条体のD2R量が低い。
> 実際に,肥満したヒトは,痩せたヒトよりも線条体のD2R量が低かった(2R)。
: これらのヒトでは dorsolateral PFC, medial orbitofrontal cortex, anterior CG のグルコース代謝も低い。
: これらの領域は,過食症との関連も示唆されており,合理的な結果と言える。
: Somatosensory cortex のグルコース代謝も肥満したヒトで低く,これは意外な結果であると述べている。
> これは inhibitory control の低下であり,肥満と関連するものと考えられる(2I)。
: Inhibitory control とは,例えば目の前に美味しいものがあるときに,健康のため食べなかったりすること。
: これは高度な脳の活動であり,dorsolateral prefrontal cortex, 帯状回 cingulate gyrus が関連。
> ただし,文献7ではOFC, ACCが重要であると書かれている。同じグループの新しい論文。
> D2Rをブロックすると,摂食量が増大する(2I)。
> 肥満モデル Zucker rat では,線条体D2Rの量が低いことが明らかにされている。
> Obese prone miceでも,線条体 D2R の量が少ない(6R, 2D)。
D2R 量と統合失調症
> 統合失調症の患者で線条体の D2R 量が増大することが,メタアナリシスから示唆されている(4)。
: 発症よりも前に D2R 量が増大するため,予防の面からも注目されている現象である。
References
- 脳単―ギリシャ語・ラテン語 (語源から覚える解剖学英単語集 (脳・神経編))
- Volkow et al. 2008a. Low dopamine striatal D2 receptors are associated with prefrontal metabolism in obese subjects: possible contributing factors. NeuroImage 42, 1537-1543.
- Hamdi et al. 1992a. Decreased striatal D2 dopamine receptors in obese Zucker rats: changes during aging. Brain Res 589, 338-340.
- McGuire et al. 2008a (Review). Functional neuroimaging in schizophrenia: diagnosis and drug discovery. Trends Pharmacol Sci 29, 91-98.
- Thanos et al. 2008b. Food restriction markedly increases dopamine D2 receptor (D2R) in a rat model of obesity as assessed with in-vivo µPET imaging ([11C] raclopride) and in-vitro ([3H] spiperone) autoradiography. Synapse 62, 50-61.
- Huang et al. 2006a. Dopamine transporter and D2 receptor binding densities in mice prone or resistant to chronic high fat diet-induced obesity. Behav Brain Res 175, 415-419.
- Volkow et al. 2011a (Review). Reward, dopamine and the control of food intake: implications for obesity. Trends Cogn Sci 15, 37-46.
-
内田 2007a (Review). 神経細胞の膜電位がもつ双安定性と状態遷移: その仕組みと情報処理における役割. 生物物理 47, 362-367.
- "Striatum" by Images are generated by Life Science Databases (LSDB). - from Anatomography, website maintained by Life Science Databases(LSDB).You can get and edit this image through URL below. 次のアドレスからこのファイルで使用している画像を取得・編集できますURL.. Licensed under CC BY-SA 2.1 jp via ウィキメディア・コモンズ.
- 八十島,小林 2006a. 線条体のドーパミン神経伝達による行動制御. 実験医学 24, 2285-2293.
- "Dopamine Pathways" by NIDA - NIDA Research Report Series - Methamphetamine Abuse and Addiction[1]. Licensed under パブリック・ドメイン via ウィキメディア・コモンズ.
- Nishi et al. 2011a. Mechanisms for the modulation of dopamine D1 receptor signaling in striatal neurons. Front Neutoanat 5, 43.
- 高草木 2009a (Review). 大脳基底核による運動の制御. 臨床神経 49, 325-334.