Hormone-sensitive lipase, ホルモン感受性リパーゼ
- 概要: HSLとは
- 酵素活性
- 構造
- 活性の制御
- 絶食時
- リン酸化
- ノックアウトマウス
- その他
ホルモン感受性リパーゼ HSL とは
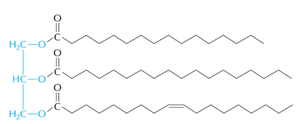
トリアシルグリセロールの構造(文献 15 より転載)。 青の部分がグリセロール骨格,黒が脂肪酸である。 ここでは 2 つの飽和脂肪酸と 1 つの不飽和脂肪酸が結合しているが,実際には様々な種類の脂肪酸が結合できる。
脂肪酸が 1 つ切り離されたものがジアシルグリセロール DAG で,HSL の主要な基質である。
- リン酸化で lipid droplet の近くへ輸送される(3)。
- PKA, perilipinと共同で脂肪分解をするが,これが adipocytes 以外で保存されているかどうかは不明(3)。
- 実際に,ペリリピンは脂肪細胞もしくは steroidogenic tissueでのみ発現している(3)。つまり,他の組織での lipolysis では HSL とペリリピンの共同作業が存在しないと思われる。
様々な HSL 分子
-
哺乳類では,promoter の使い分けによって 3 つの isoform がある。サイズは 84 - 130
kDa(3)。
-
多くの知見は脂肪組織を使った実験から得られており,言及がない場合は HSLadi
についてのものと考えられる。
-
精巣特異的な HSLtes があり,cholesteryl ester hydrolase として精子形成に必要(7)。
バクテリアも HSL に相同と考えられる分子をもっており,HSL の起源は非常に古いと考えられている。ただし,構造の一部が似ているだけで,その機能には大きな違いがありそうである。
-
哺乳類 HSL は,構造的に bacteria の type B carboxyesterase に似る(5)。
-
Bactarial HSL は一般に 34-40 kDa と小さく,哺乳類 HSL の C-terminal
region に似る(9I)。
-
BFAE from Bacillus subtilis, lipase 2 from Moraxella TA 114などが HSL family protein(9I)。
-
Bactarial HSL
は水溶性の短鎖脂肪酸は分解するが,エマルジョン中の長鎖脂肪酸はできない(9R)。
-
このことから non-lipolytic carboxyestelase と位置づけられる。ヒト HSLは
lipolytic である(9R)。
> 他のリパーゼ(pancreasic lipase, lipoprotein lipase など)と相同性を示さない(14)。
: Exon 6 と他のリパーゼの相同性が著しく低く,ここがどこからか飛んできた mosaic protein かも。
: Exon 6 は phase I(コドンの一番目の塩基で切れる)の構造があり,これも mosaic protein の特徴。
酵素活性 Enzymatic activity
> HSL の酵素活性は広く,acylglycerol のほか cholesteryl ester, retinyl ester, steroid ester も分解する(3)。
: TAG : DAG : MAG に対する活性は,1 : 10 : 5 である(4)。
: Cholesteryl ester (CE) に対する分解活性は TAG の約 2 倍で,生理的にどのように働いているのか興味深い(3)。
構造 Structure
遺伝子の構造
> HSLtes は,different promoter usage で5'側に特異的エクソンをもつ(7I)。
> 5' 側の isoform-specific exon が翻訳領域をコードするのは珍しい。大体は非翻訳領域。
> 哺乳類の脂肪組織,adrenal gland,卵巣では,転写は複数の exon (A, B, C, D, or exon 1) から始まる(4)。
: Exons B, C, D は非翻訳領域なので,どこから転写されるかはアミノ酸配列に影響しない。
: Exon A は 43 アミノ酸を HSL の N 末端側に付加する。
> 哺乳類の精巣では,2つの組織特異的エクソン(T1, T2)がある(4)。
: Exon T1 は,300 アミノ酸を N 末端側に付加する。T2 は非翻訳領域をコードする。
タンパク質の構造
> N-terminal domainはタンパク質相互作用 or 基質結合,C-terminal domainは活性ドメイン(4)。
> N-terminal domainは他のタンパク質と相同性を示さない。Cはbactarial HSLsに似る(9I)。
> Rat N-terminal domain (AA1-300) は,ダイマー化およびFABP4との結合に関与(4)。
> Rat C-terminal domain は Ser-423, Asp-703, His-733から成る catalytic triad を含む(4)。
> Rat regulatory module (AA521-669) はloop regionで,既知の全てのリン酸化サイトを含む(4)。
> Rat putative lipid binding domain は AA658 あたりにある(4)。
活性の制御
5' 上流域
> ヒツジ HSL の 5' 上流域(転写開始点から 1244 bp)にあった転写因子結合サイト(12)。
Stimulating protein 1 (Sp1), CCAAT-box Binding Factors (CBFs), Activator Protein 2 (AP2) and Glucocorticoid Receptor (GR), as well as other cis-acting regions denominated as Insulin Response Element (IRE), Glucose Response Element (GRE), Fat Specific Element (FSE) and cAMP Response Element (CRE).
cAMP
> 3T3-F442A および BFC-1 脂肪細胞では,cAMP または PMA 処理で HSL の mRNA 量が低下する(13)。
: PMA (phorbol 12-myristate 13-acetate) は,PKC の活性化剤である。
: cAMP-PKA 経路,PKC 経路による HSL の活性化を考えると意外な結果。フィードバック?
: 短期の飢餓では,HSL の mRNA 量が低下するという報告も引用されている(13D)。
ホルモンによる制御
グルカゴン glucagon および カテコールアミン catecholamine によって活性化される。PKA シグナルを介した作用であることがよく知られている。
> 成長ホルモン growth hormone によって,ニジマス肝臓の HSL がリン酸化される(16)。
: 哺乳類でも示されているのか?
: PKC, ERK を介する経路に依存することが阻害剤を使って示されている。
リン酸化 Phosphorylation
Rat HSLのリン酸化サイト
Ser563: PKA (3,4), glycogen synthase kinase-4 (4)
> site 1, regulatory siteとも呼ばれる(4)。
> 563のみ,または563と565をAlaに置換しても,活性は失われない(4)。
> protein phosphatase 2A (PP2A) とPP2Cに脱リン酸化される(4)。
Ser565: AMPK (11), Ca2+/calmodulin-dependent protein kinase II (4)
> Site 2, basal siteとも呼ばれる(4)。ここのリン酸化は活性を負に制御するかもしれない。
> かつては活性に影響なしとされていたが,ここに変異を入れると活性がわずかに上昇する。
> AMPKによってリン酸化されると,lipolysis が阻害される (11。
> 主にPP2Aに脱リン酸化されるが,PP1およびPP2Cも重要かもしれない(4)。
Ser600: Erk (3,4)
Ser659: PKA (3, 4)
> Ser660とともに新しく発見されたリン酸化サイト(4)。活性に必要。変異を入れると活性がなくなる。
Ser660: PKA (3, 4)
Human HSLのリン酸化サイト
Ser 554: (rat Ser565 に相当);
Ser553 と書かれているが,この AMPK によるリン酸化サイトは,それ自体は活性に関係なく,Ser552 のリン酸化を阻害する。
生物種未詳
> Ser659 および 660 が PKA にリン酸化され,活性化する。ここに変異を入れると活性がなくなる(3)。
> Ser563 も PKA site であるが,その機能は不明である(3)。
> カテコールアミン,Erk によって Ser600 が,AMPK によって Ser-565 がリン酸化される(3)。
> Ser423 を置換すると,esterase 活性も lipase 活性もなくなる(4, cited from Holm et al. 1994)。
ノックアウトマウス Knockout mice
> KO miceの体重およびWAT重量は正常(1D)。WATは小さいという報告も(8)。
> HSL-deficient mice are lean, and they effectively mobilize FFAs from TG (2I).
> KO miceでも basal lipolysis は起こる。これはHSLの他にも lipase があることを示唆する(3)。
: KOではDAGが蓄積するので,HSL以外の lipase はTAG lipaseであることが予想される(3)。
: のちに,TAGの分解活性が高いadipose tissue triglyceride lipase (ATGL) が発見されている。
> DAG 分解活性は,wtの1/20から1/30程度(1)。
高脂肪食を与えた場合
> 高脂肪食で一般に体重は増えるが,HSL-/-は増え具合がwtよりも穏やか。BATでの脂質燃焼が活発(8)。
> normal chowおよびhigh-fat dietを与えたHSL-/-は,白色脂肪組織がwtよりも小さくなる(8)。
> HSLはWATでPPARgのリガンドを作っており,KO miceでは脂肪細胞の分化が抑制されるためと考えている。
> high-fat diet を与えた KO mice の BAT では脂質の燃焼が wt より活発。コレステロールの蓄積が原因か? (8)
その他未整理
> KO miceでは血中 NEFA 量が減り,筋肉や心臓でのインスリン感受性が増大する(5)。
> HSL-/- mice は血中 NEFA 量がnormal chowでもhigh-fat dietでも低い(8)。
> HSL-/- mice は不妊である(7I)。
> Drosophilaの油滴タンパク質のリン酸化にも cAMP, PKA が関与。哺乳類lipolysisと似た機構がある(10)。
References
- Haemmerle 2002. JBC, 277, 4806-4815.
- Haemmerle 2006. Science, 312, 734-737.
- Holm 2003 (Review). Biochem Soc Transac, 31, 1120-1124.
- Lampidonis et al. 2011aR (Review). The resurgence of Hormone-Sensitive Lipase (HSL) in mammalian lipolysis. Gene 477, 1-11.
- Laurell 2000. Protein Engineering, 13, 711-717.
- Park 2005. Am J Physiol Endocrinol Metab, 289, E30-E39.
- Vallet-Erdtmann 2004. JBC, 279, 42875-42880.
- Harada 2003a. Am J Physiol Endocrinol Metab, 285, E1182-E1195.
- Chahinian 2005a. BBA, 1738, 29-36.
- Schlegel 2007a (Review). Lessons from "lower" organisms: what worms, flies, and zebrafish can teach us about human energy metabolism. PLoS Genet 3, e199.
- Daval et al. 2005a. Anti-lipolytic action of AMP-activated protein kinase in rodent adipocytes. J Biol Chem 280, 25250-25257.
- Lampidonis et al. 2008a. Cloning and functional characterization of the 5' regulatory region of ovine hormone sensitive lipase (HSL) gene. Gene 427, 65-79.
- Plee-Gautier et al. 1996a. Inhibition of hormone-sensetive lipase gene expression by cAMP and phorbol esters in 3T3-F442A and BFC-1 adipocytes. Biochem J 318, 1057-1063.
- Langin et al. 1993a. Gene organization and primary structure of human hormone-sensitive lipase: possible significance of a sequence homology with a lipase of Moraxella TA144, an antarctic bacterium. PNAS, 90, 4897-4901.
- Molecular Biology of the Cell, 5th edition.